MedChemExpress LLC品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
抗 COVID-19 的 mRNA 疫苗技术|MedChemExpress (MCE)
417 人阅读发布时间:2023-11-23 13:13
mRNA 疫苗是在体外转录好的一段编码抗原蛋白的完整 mRNA,包含 5 部分:① 5’ 帽子结构,② 5’ 非编码区 (untranslated region, UTR),③ 一个编码抗原的开放阅读框(open reading frame, ORF), ④ 3’ 非编码区,⑤ 3’ poly (A) 尾 (图 1)[1]。
 Tips:(上下滑动查看更多)
Tips:(上下滑动查看更多)
(1) 5’ 帽子结构包含一个 7-甲基鸟苷 (m7G),通过三磷酸桥连接到 mRNA 的5’端。5’ 端第一个或第二个核苷酸在核糖的 2’ 羟基上被甲基化 (2’ - O- methylation),这阻止了 RNA 被细胞识别,从而阻止了非预期的免疫反应。此外,5’ 帽子结构在空间上保护 mRNA 不被外切酶降解。
(2) 在 3’ 端,poly(A) 尾的长度间接调控 mRNA 的翻译和半衰期。一个足够长的尾巴 (100-150 bp) 是与 poly (A) 结合蛋白相互作用所必需的。poly (A) 结合蛋白和翻译起始因子形成复合物招募核糖体启动翻译,并且保护帽子结构免受降解酶。
(3) 编码区侧翼的 5’ UTR 和 3’ UTR 调控 mRNA 翻译、半衰期和亚细胞定位。开放阅读框包含翻译成蛋白质的编码序列,可以通过将很少使用的密码子替换为编码相同氨基酸残基的更频繁出现的密码子来优化,从而在不改变蛋白质序列的情况下增加翻译量。例如, CureVac AG 公司在新冠疫苗 CVnCoV 用 G 或 C 代替 A 或 U(人类 mRNA 密码子很少在第三位有 A 或 U)。
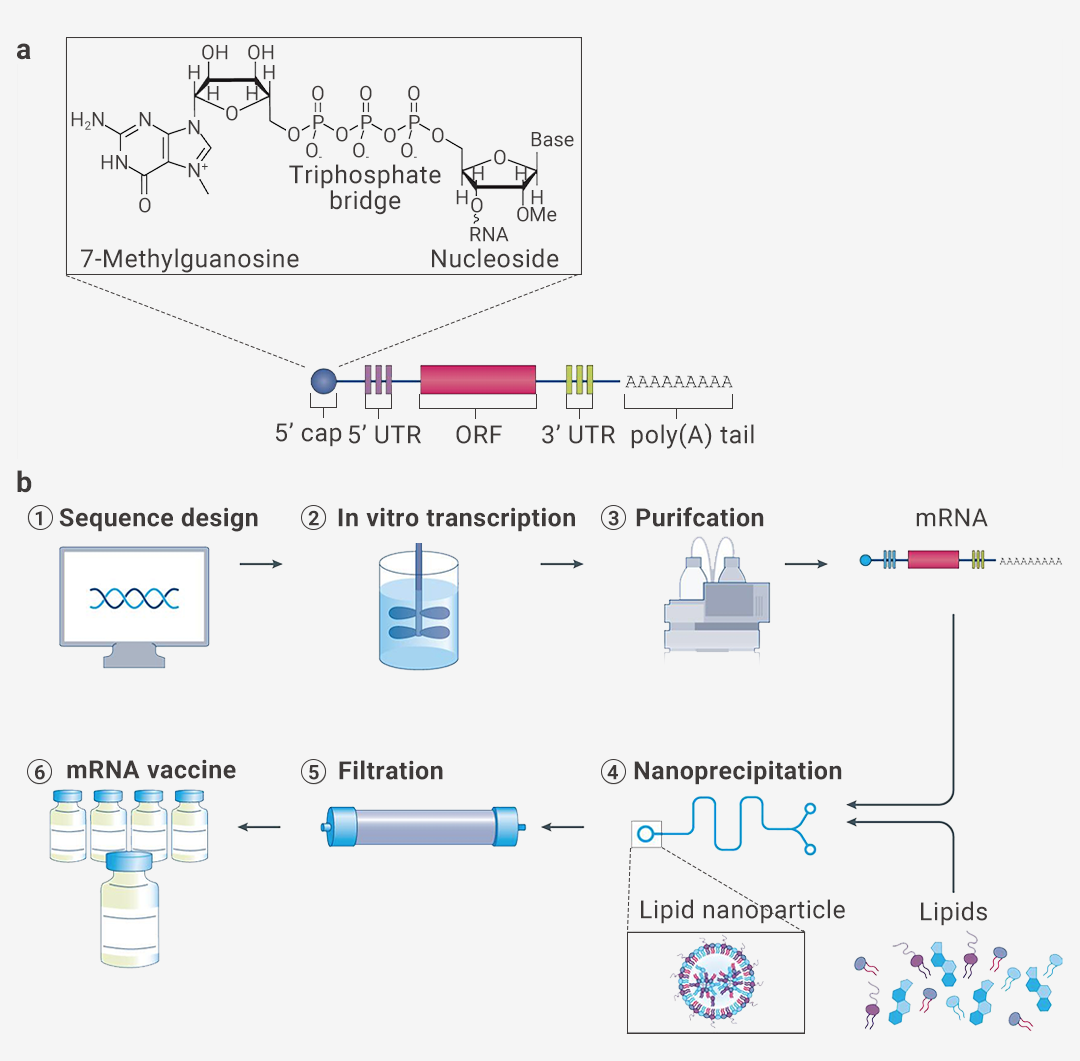
图 1. 将无细胞生产的体外转录 mRNA 制成脂质纳米颗粒疫苗[1]。
A.体外转录 mRNA 的结构示意图。B. 制备 mRNA 疫苗的过程。(1) 病原体基因组测序完成后,设计目标抗原的序列并插入到质粒中。(2) 在体外通过噬菌体聚合酶将质粒转录为 mRNA。(3) 通过高效液相色谱 (HPLC) 纯化 mRNA以去除污染物和反应物。(4) 将纯化好的 mRNA 与脂质在微流控混合器中速混合,形成脂质纳米颗粒。(5) 将纳米颗粒溶液透析或过滤以除去非水溶剂和任何未封装的 mRNA。(6) 将过滤后的 mRNA 疫苗溶液保存在灭菌的瓶中。

mRNA 疫苗不需要复杂的细胞培养体系和表达纯化体系,可在实验室直接合成,因而可以实现快速大规模生产。这些优势使得 mRNA 疫苗在 COVID-19 疫情防控中发挥着重要作用。
但 mRNA 不稳定且难以递送,而且,体外产生的 mRNA 会引起炎症反应。然而,在两个关键技术上的突破使得 mRNA 疫苗技术高歌猛进。
▐ 脂质纳米递送系统裸的 mRNA 在体液中容易被核酸酶迅速降解,难以在靶组织中积累。此外,免疫系统也能够识别并降解外源性的核酸引发免疫反应[2]。所以 mRNA 的安全高效递送对于 mRNA 疫苗的推广使用十分重要。脂质纳米颗粒可保护核酸不被降解,最大限度地向靶细胞递送,并减少核酸对脱靶细胞的暴露。(详见往期推文:“药物如何递送 ?脂质纳米颗粒!”)。基于脂质的纳米颗粒是临床上先进的 mRNA 递送载体。截至 2021 年 6 月,所有正在开发或批准用于临床的 SARS-CoV-2 mRNA 疫苗均采用脂质纳米颗粒(LNP)。

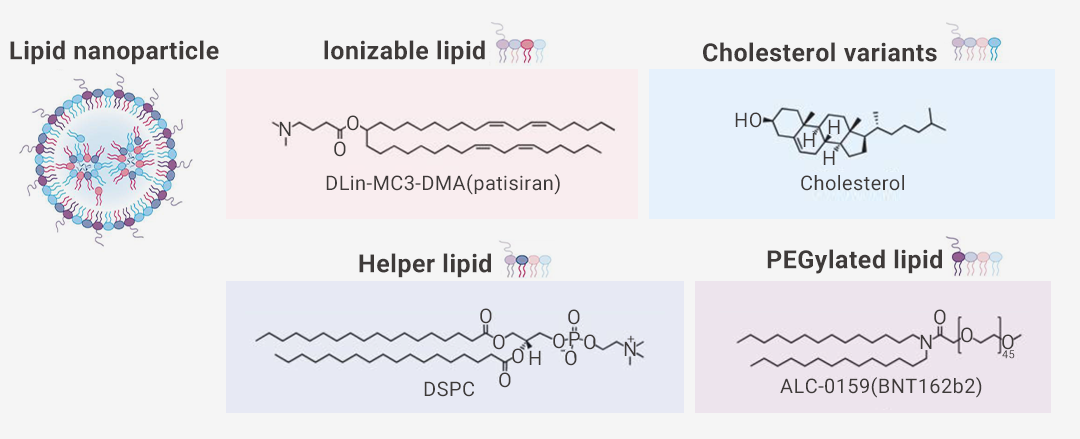
图 2. 脂质纳米颗粒及组成[1]。
▐ 核苷修饰
Katalin Karikó 和 Drew Weissman 发现树突状细胞和 TLR 表达的细胞可被细菌和线粒体 RNA 有效激活,但不能被哺乳动物总 RNA(其中含有丰富的修饰核苷)激活[3]。因此,他们假设核苷修饰抑制了 RNA 的免疫作用。通过使用含有修饰核苷的 RNA 刺激树突状细胞,发现修饰的核苷确实可以阻止 TLR 受体的识别,特别是修饰的尿苷,诱导的 TNF-α 的表达量显著降低[3]。
Moderna 和辉瑞-公司的新冠疫苗基于这一结论开发出含有修饰核苷的 mRNA 疫苗。并且这两款新冠疫苗都在 III 期临床试验中产生了 >94% 的疗效。
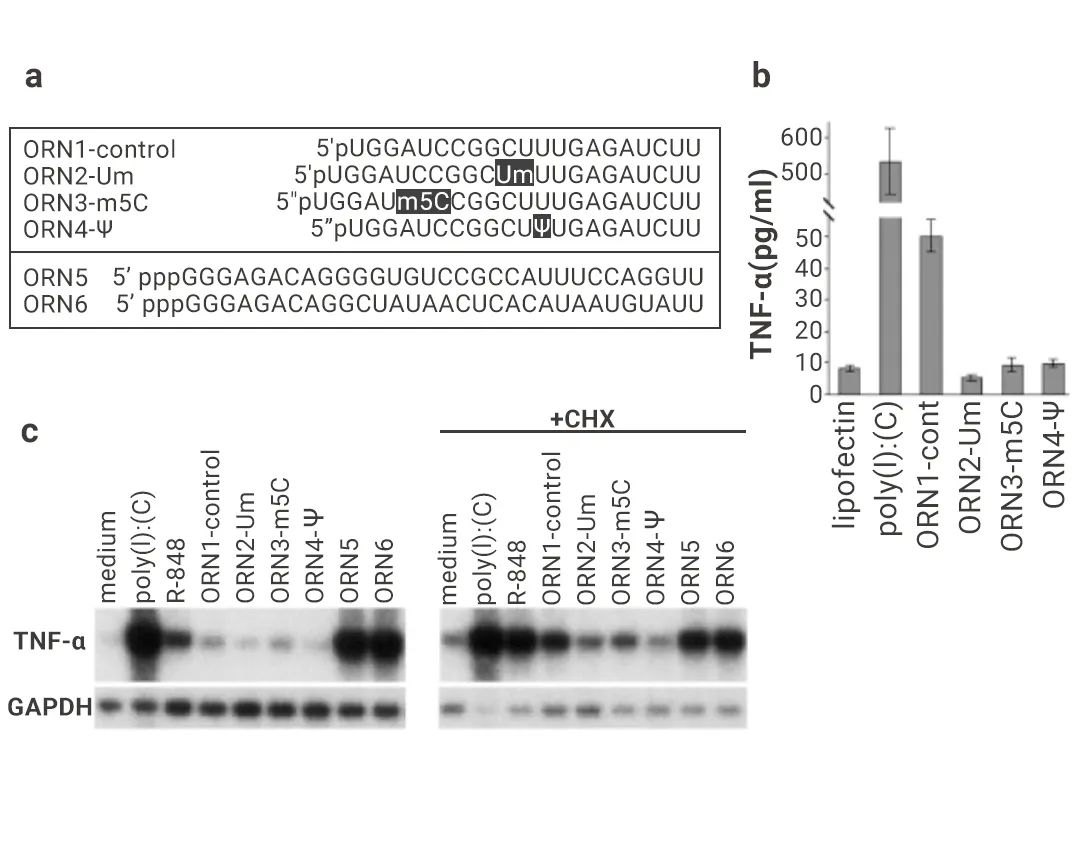
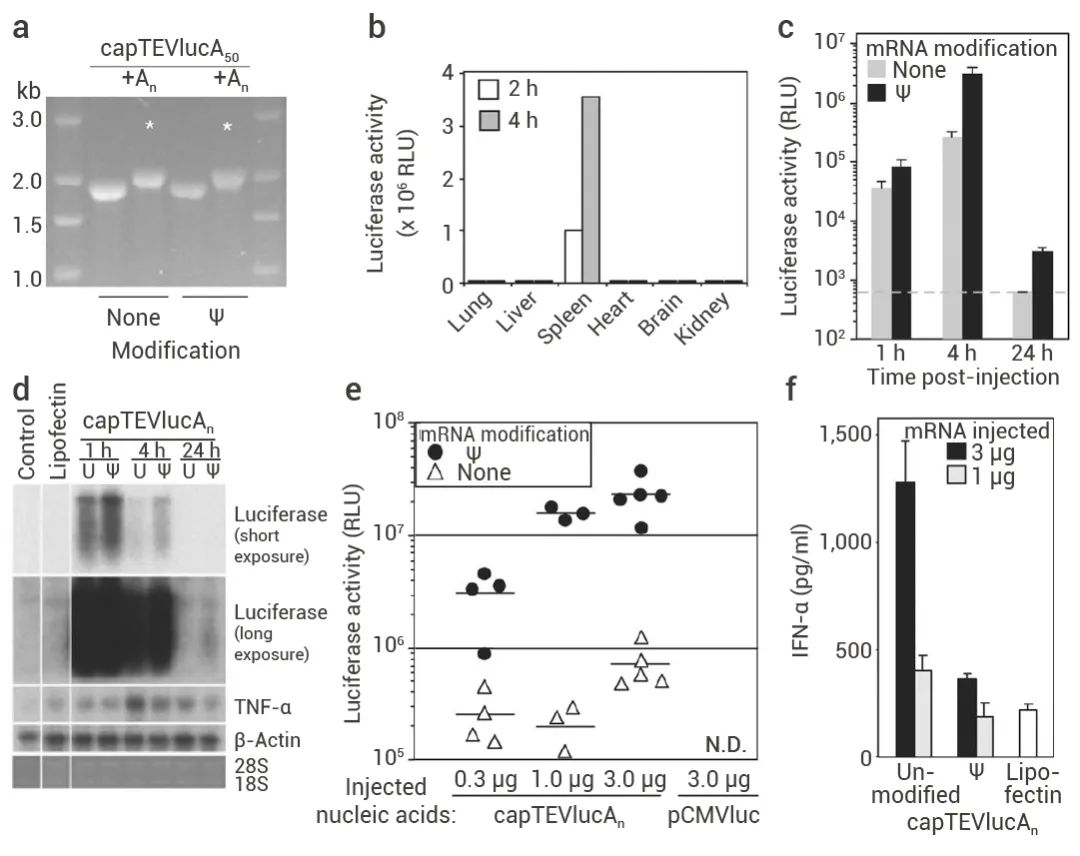
图 3. Katalin Karikó 和 Drew Weissman 对 RNA 核苷修饰的研究[3][4]。
左图: RNA 转染树突状细胞诱导表达TNF-α[3]: a. 化学合成 (ORN1-4) 或体外转录 (ORN5-6) 的寡核苷酸序列转染人树突状细胞; b-c. ELISA 或 Northern blot 检测 TNF-α 表达量。右图: Ψ 修饰的 mRNA 具有更高的翻译能力[4]: a. 体外转录的含有或不含Ψ修饰的 capTEVlucA50 用 poly (A) 聚合酶延长了 3 '端 poly (A) 尾 (+An), 用于动物研究的 mRNA 用星号表示; b-d. 尾静脉注射含有或不含 Ψ 修饰的 mRNA (capTEVluc-An) 脂质体。处死动物后, (b-c) 对各组织进行荧光素酶活性测定; (d) 并用 Northern blot 检测 luciferase 和 TNF-α; e-f. 尾静脉注射含有或不含 Ψ 修饰的 mRNA (capTEVluc-An) 或 pCMVluc 质粒脂质体。处死动物后,(e) 进行荧光素酶活性测定,(F) 用 ELISA 检测血清中 TNF-α 的含量。在后续研究中,Katalin Karikó 和 Drew Weissman 还证明了相比未修饰的 mRNA,修饰后的 mRNA 在实验小鼠体内具有更高的翻译能力,可以显著增加蛋白合成[4]。至此 mRNA 临床应用中的关键障碍被突破。诺贝尔委员会也正是基于 Katalin Karikó 和 Drew Weissman 这些开创性的发现将今年的诺贝尔生理学或医学奖授予他们。

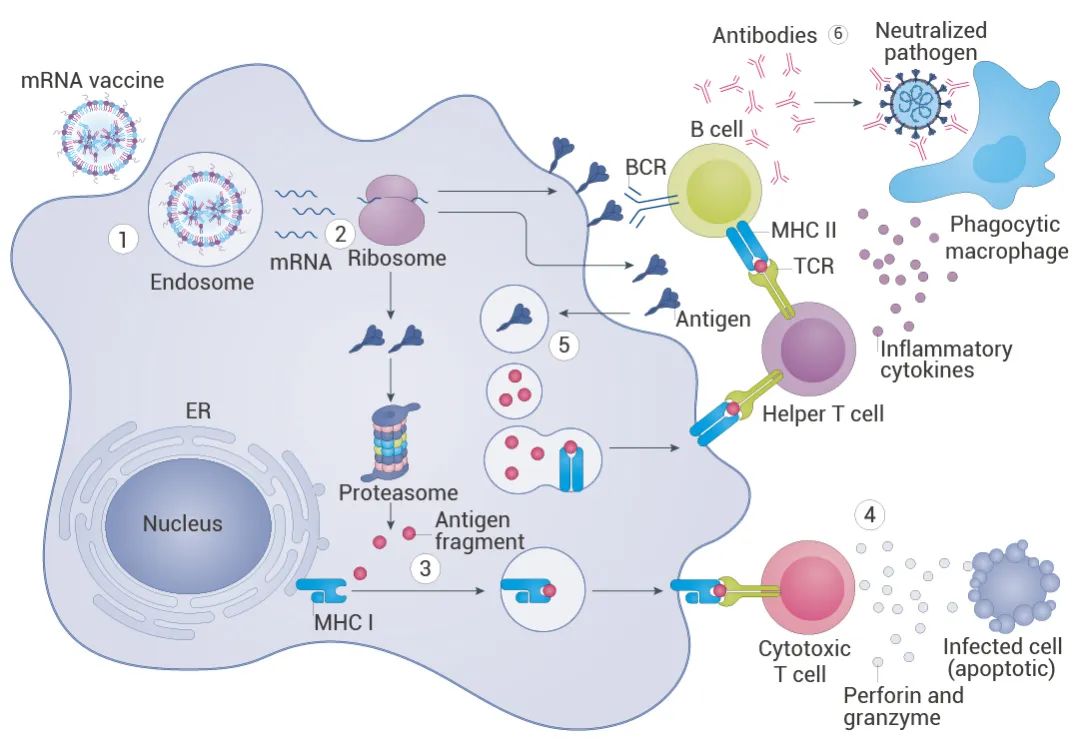
图 4. mRNA 疫苗引起免疫反应的机制示意]图[1]。
▐ mRNA 疫苗用于癌症治疗mRNA 疫苗在传染性疾病防治领域的成功激发了人们对 mRNA 疫苗在癌症免疫治疗领域的应用的兴趣 (表 1)[5]。一种方法是通过表达缺失或改变的肿瘤抑制蛋白来修改免疫抑制肿瘤微环境。另一种方法是 mRNA 疫苗训练免疫系统寻找并杀死癌细胞。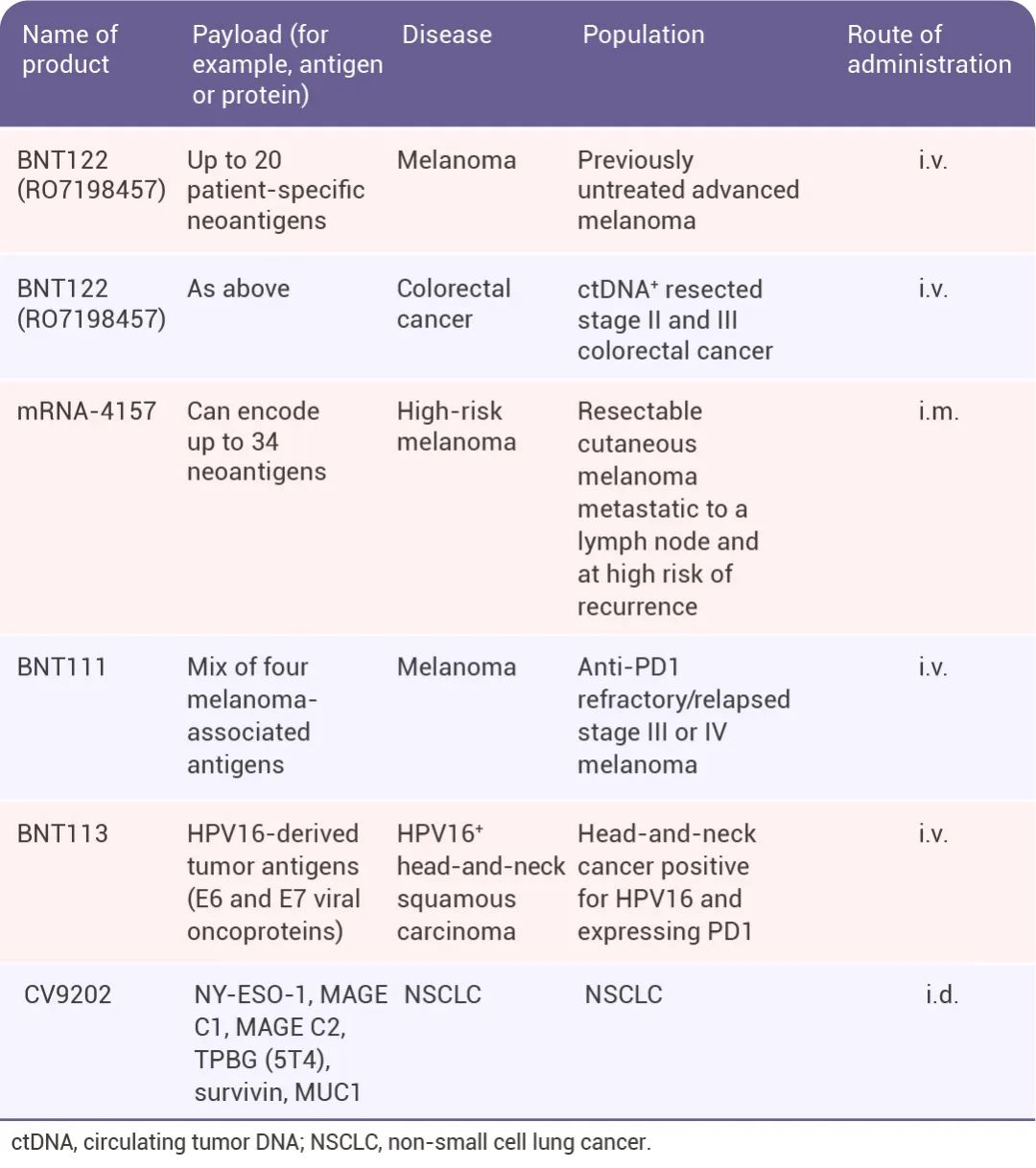

|
帽类似物 使用帽类似物是体外合成 5’加帽 mRNA 最常用的方法。帽子结构的存在赋予了 mRNA 的稳定性,使其能够高效翻译。 |
|
m7GpppA diammonium 一种二核苷酸帽类似物,可用于体外 RNA 转录。 |
|
3'Ome-m7GpppAmpG ammonium 一种含有锁核酸的三核苷酸帽类似物,可用于体外 RNA 转录。 |
 [1] Chaudhary N, et al. mRNA vaccines for infectious diseases: principles, delivery and clinical translation [published correction appears in Nat Rev Drug Discov. 2021 Sep 21;:]. Nat Rev Drug Discov. 2021;20(11):817-838.
[1] Chaudhary N, et al. mRNA vaccines for infectious diseases: principles, delivery and clinical translation [published correction appears in Nat Rev Drug Discov. 2021 Sep 21;:]. Nat Rev Drug Discov. 2021;20(11):817-838. [2] Hou X, et al. Lipid nanoparticles for mRNA delivery. Nat Rev Mater. 2021;6(12):1078-1094.
[3] Karikó K, et al. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity. 2005;23(2):165-175.
[4] Karikó K, et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther. 2008;16(11):1833-1840. [5] Barbier AJ, et al. The clinical progress of mRNA vaccines and immunotherapies. Nat Biotechnol. 2022;40(6):840-854.







