MedChemExpress LLC品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
细胞动态可塑性:Wnt/β-catenin 如何 "燎动" 肿瘤 EMT ?| MedChemExpress (MCE)
795 人阅读发布时间:2023-11-10 14:46
 提到 EMT,大多小伙伴们都会立刻想到肿瘤,我们常说,肿瘤具有 EMT 特性,但上皮-间充质转化 (EMT) 也是细胞形态发生过程中不可或缺的机制,因为没有间充质细胞,就永远无法形成组织和器官[1]。
EMT 过程描述了静止上皮细胞向间充质、运动表型的分化,最初在发育早期观察到[1]。后来人们发现 EMT 不仅对于发育和伤口愈合至关重要,而且代表了原发性肿瘤形成和转移的一个显著特性[2]。
提到 EMT,大多小伙伴们都会立刻想到肿瘤,我们常说,肿瘤具有 EMT 特性,但上皮-间充质转化 (EMT) 也是细胞形态发生过程中不可或缺的机制,因为没有间充质细胞,就永远无法形成组织和器官[1]。
EMT 过程描述了静止上皮细胞向间充质、运动表型的分化,最初在发育早期观察到[1]。后来人们发现 EMT 不仅对于发育和伤口愈合至关重要,而且代表了原发性肿瘤形成和转移的一个显著特性[2]。




图 1. 上皮细胞可塑性的循环及诱导细胞 EMT 发生[1]。
A. 上皮细胞可以通过上皮-间充质转化过程转化为间充质细胞,在此期间上皮细胞失去了许多上皮特性,并具有间充质细胞的典型特性。在大多数生物发育的早期阶段,上皮间质转化 (EMT) 调控着重要的过程,在缺乏 EMT 的情况下,发育不能经过囊胚期。用 Matrix metalloproteinase-3 (C) 处理 SCp2 小鼠乳腺细胞 (B) 诱导 EMT。 EMT 过程可促进癌症干细胞样,免疫逃逸,多重抵抗,侵袭性表型,介导癌细胞的可塑性,允许其持续和不可逆地适应不断变化的条件,与肿瘤侵袭转移、耐药及免疫逃逸密不可分[3][4][5]。
EMT 过程可促进癌症干细胞样,免疫逃逸,多重抵抗,侵袭性表型,介导癌细胞的可塑性,允许其持续和不可逆地适应不断变化的条件,与肿瘤侵袭转移、耐药及免疫逃逸密不可分[3][4][5]。
 EMT 受多种信号通路调节,例如 TGF-β、Wnt/β-catenin、Hedgehog 和 Notch 信号通路,这些途径通过刺激 Snail、Twist 和 ZEB1/2 等转录因子来触发 EMT。在所有信号通路中,Wnt/β-catenin 通路在 EMT 的调控中发挥着关键作用[6]。
▐ Wnt/β-catenin 的激活诱发 EMT
正常情况下,Wnt/β-catenin 信号通路的负调控因子,如结肠腺瘤性息肉病蛋白(APC)、 糖原合成激酶3蛋白 (GSK-3) 和轴蛋白(Axin)等可与 β-catenin 结合形成复合物从而发生磷酸化,并进一步降解[7]。
EMT 受多种信号通路调节,例如 TGF-β、Wnt/β-catenin、Hedgehog 和 Notch 信号通路,这些途径通过刺激 Snail、Twist 和 ZEB1/2 等转录因子来触发 EMT。在所有信号通路中,Wnt/β-catenin 通路在 EMT 的调控中发挥着关键作用[6]。
▐ Wnt/β-catenin 的激活诱发 EMT
正常情况下,Wnt/β-catenin 信号通路的负调控因子,如结肠腺瘤性息肉病蛋白(APC)、 糖原合成激酶3蛋白 (GSK-3) 和轴蛋白(Axin)等可与 β-catenin 结合形成复合物从而发生磷酸化,并进一步降解[7]。




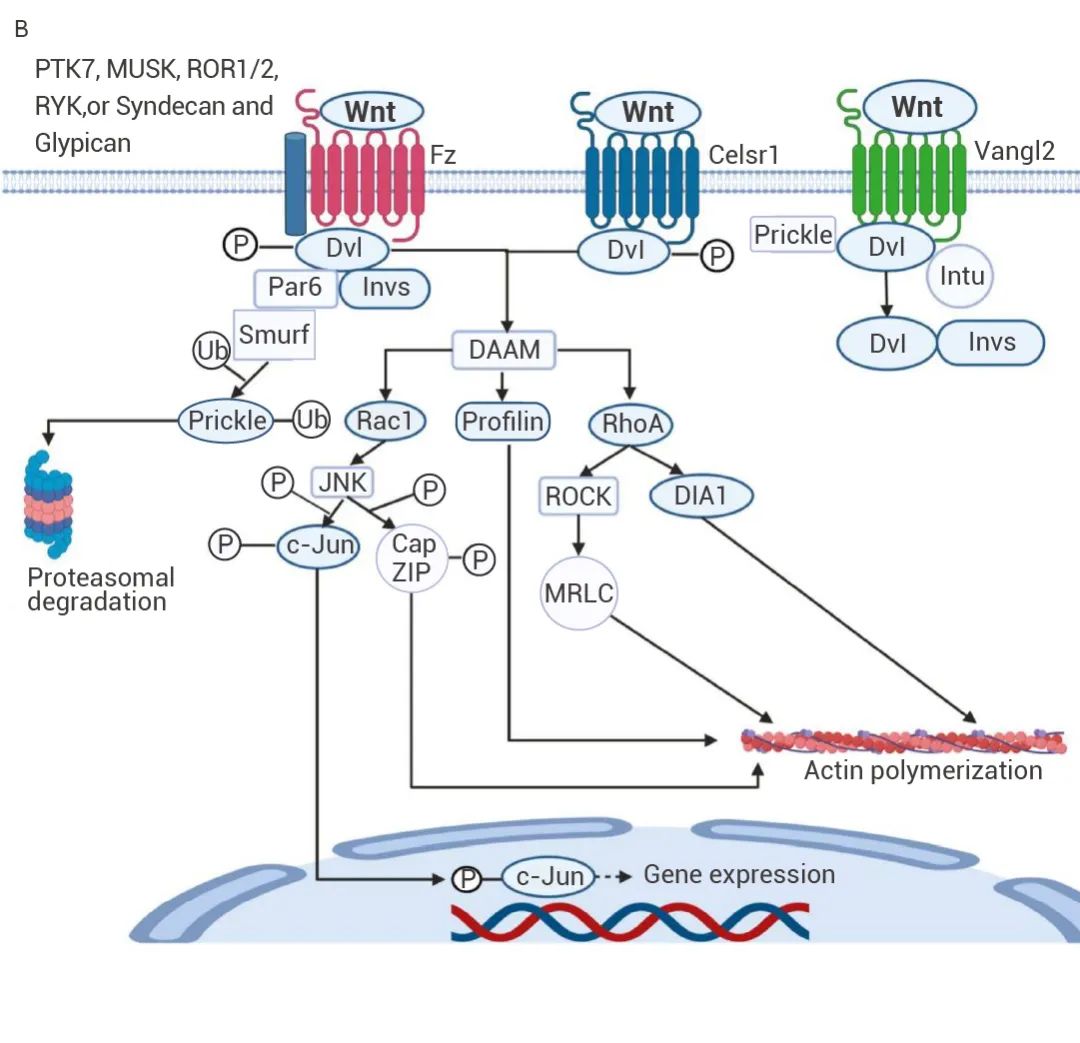


 大量研究表明,Wnt/β-catenin 信号通路的失调会导致 EMT,而 Wnt/β-catenin 的调控又有谁在参与呢?
▐ miRNA 靶向 Wnt/β-catenin 来调节 EMT
Wnt/β-catenin 信号传导激活的核心是 β-catenin 在细胞质中的积累。因此,针对 β-catenin 的 miRNA 可能通过靶向 Wnt 信号通路或其下游转录因子来抑制 EMT。
今年 8 月,Dongsheng Zhu 等人揭示了miR-199b-3p在骨肉瘤 (OS) 的形成和进展中发挥关键作用。miR-199b-3p 可与 CCDC88A 的 3' 非翻译区 (UTR) 结合,下调 CCDC88A 的表达水平,抑制 EMT 和 Wnt/β-catenin 信号通路,从而介导其对 OS 细胞增殖和侵袭的抑瘤作用[11]。
大量研究表明,Wnt/β-catenin 信号通路的失调会导致 EMT,而 Wnt/β-catenin 的调控又有谁在参与呢?
▐ miRNA 靶向 Wnt/β-catenin 来调节 EMT
Wnt/β-catenin 信号传导激活的核心是 β-catenin 在细胞质中的积累。因此,针对 β-catenin 的 miRNA 可能通过靶向 Wnt 信号通路或其下游转录因子来抑制 EMT。
今年 8 月,Dongsheng Zhu 等人揭示了miR-199b-3p在骨肉瘤 (OS) 的形成和进展中发挥关键作用。miR-199b-3p 可与 CCDC88A 的 3' 非翻译区 (UTR) 结合,下调 CCDC88A 的表达水平,抑制 EMT 和 Wnt/β-catenin 信号通路,从而介导其对 OS 细胞增殖和侵袭的抑瘤作用[11]。




 本期小 M 为大家介绍了激活 Wnt/β-catenin 通路会诱发肿瘤 EMT 的产生,Wnt 通路的激活途径以及 Wnt/β-catenin 通路的相关调控。细胞的动态可塑性的调控也是研究者们寻求疾病治愈方法的重要突破点,涉及相关课题的小伙伴们可以点赞收藏喔~
本期小 M 为大家介绍了激活 Wnt/β-catenin 通路会诱发肿瘤 EMT 的产生,Wnt 通路的激活途径以及 Wnt/β-catenin 通路的相关调控。细胞的动态可塑性的调控也是研究者们寻求疾病治愈方法的重要突破点,涉及相关课题的小伙伴们可以点赞收藏喔~

| IWP-2 靶向结合 Porcupine ,Wnt 加工和分泌的抑制剂。 |
| XAV939 Tankyrase 1 抑制剂,靶向 Axin,抑制 Wnt 信号传导。 |
| IWR-1 IWR-1是端锚聚合酶抑制剂,抑制Wnt/β-catenin信号传导途径。 |
| SB-216763 ATP 竞争性的 GSK3 抑制剂。 |
| ICG-001 结合 CREB 蛋白的 β-catenin/TCF 转录抑制剂。 |
| MSAB MSAB 是 Wnt/β-catenin 信号传导的有效和选择性抑制剂。MSAB 与 β-catenin 结合,促进其降解,并下调 Wnt/β-catenin 靶基因。 |
| NSC668036 Frizzled-Dvl 结构域抑制剂,阻断 Wnt 信号。 |
| Box5 Box5 是一种有效的 Wnt5a 拮抗剂。Box5 抑制 Wnt5a 信号并抑制 Wnt5a 介导的 Ca2+ 释放。Box5 抑制细胞迁移。 |
| TWS119 GSK-3β 抑制剂,激活 Wnt/β-catenin 通路。 |
| SKL2001 SKL2001 是 Wnt/β-catenin 信号通路的激动剂,具有抗肿瘤活性。SKL2001 通过破坏 Axin/β-catenin 相互作用,稳定细胞内 β-catenin。 |



[1] Thiery JP, et al. Complex networks orchestrate epithelial-mesenchymal transitions. Nat Rev Mol Cell Biol. 2006 Feb, 7(2):131-42.
[2] Bakir B, et al. EMT, MET, Plasticity, and Tumor Metastasis. Trends Cell Biol. 2020 Oct, 30(10):764-776.
[3] Yeung KT, et al. Epithelial-mesenchymal transition in tumor metastasis. Mol Oncol. 2017 Jan, 11(1): 28-39.
[4] Brabletz S, et al. Dynamic EMT: a multi-tool for tumor progression. EMBO J. 2021 Sep 15, 40(18): e108647.
[5] Hay ED. An overview of epithelio-mesenchymal transformation. Acta Anat (Basel). 1995, 154(1): 8-20.
[6] Lei Y, et al. MicroRNAs target the Wnt/β‑catenin signaling pathway to regulate epithelial‑mesenchymal transition in cancer (Review). Oncol Rep. 2020 Oct, 44(4): 1299-1313.
[7] Qin K, et al. Canonical and noncanonical Wnt signaling: Multilayered mediators, signaling mechanisms and major signaling crosstalk. Genes Dis. 2023 Mar 24, 11(1): 103-134.
[8] Buyuk B, et al. Epithelial-to-Mesenchymal Transition Signaling Pathways Responsible for Breast Cancer Metastasis. Cell Mol Bioeng. 2021 Sep 2, 15(1): 1-13.
[9] Yu F, et al. Wnt/β-catenin signaling in cancers and targeted therapies. Signal Transduct Target Ther. 2021 Aug 30, 6(1): 307.
[10] Lecarpentier Y, et al. Multiple Targets of the Canonical WNT/β-Catenin Signaling in Cancers. Front Oncol. 2019 Nov 18, 9: 1248.
[11] Zhu D, et al. hsa-miR-199b-3p suppresses osteosarcoma progression by targeting CCDC88A, inhibiting epithelial-to-mesenchymal transition, and Wnt/beta-catenin signaling pathway. Sci Rep. 2023 Aug 2, 13(1): 12544.
[12] Ling DJ, et al. MicroRNA-145 inhibits lung cancer cell metastasis. Mol Med Rep. 2015 Apr, 11(4): 3108-14.
[13] Qu J, et al. MicroRNA-33b inhibits lung adenocarcinoma cell growth, invasion, and epithelial-mesenchymal transition by suppressing Wnt/β-catenin/ZEB1 signaling. Int J Oncol. 2015 Dec, 47(6): 2141-52.
[14] Kang AR, et al. A novel RIP1-mediated canonical WNT signaling pathway that promotes colorectal cancer metastasis via β -catenin stabilization-induced EMT. Cancer Gene Ther. 2023 Jul 27.
[15] Zhou, et al. Dual regulation of Snail by GSK-3β-mediated phosphorylation in control of epithelial–mesenchymal transition. Nat Cell Biol. 2004, 6: 931-940.
[16] Kaler P, et al. Macrophage-derived IL-1beta stimulates Wnt signaling and growth of colon cancer cells: a crosstalk interrupted by vitamin D3. Oncogene. 2009 Nov 5, 28(44): 3892-3902.
[17] Long X, et al. MRGBP promotes colorectal cancer metastasis via DKK1/Wnt/β-catenin and NF-kB/p65 pathways mediated EMT. Exp Cell Res. 2022 Dec 1, 421(1): 113375.






